
免疫组织化学 (Immunocytochemistry, IHC) 是一门利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色的技术,能够对组织细胞内的抗原进行定位、定性及相对定量检测,进而深入探究其功能。
IHC实验步骤繁琐,包括切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片和分析等,每一个细节都可能影响到最终的染色结果。无论是从没做过IHC的实验小白,还是想要对当前方法进行优化的大牛,这篇秘籍都能让您有所收获。文末还附有IHC通关的秘密武器——Bioss全新上市的IHC即用型试剂盒,助您一次获得文献级的图像结果。
切片制作
1.染色结果不理想,细胞核发灰模糊,对比不鲜明。
解决方法:①半小时内完成取材,组织离体后尽快固定;
②固定液选择视组织而定,有致密外膜用Carnoy液,活检用Bouin液,固定液体积要超过组织体积5倍以上,量少应中途换液1~3次;
③固定时间在4~24 h之间,长时间固定会影响抗原决定簇的暴露,且容易出现自发荧光及非特异性染色。
2.蜡块出现组织收缩凹陷,在抗原修复时脱片。
解决方法:①梯度酒精脱水尽量彻底充分;
②二甲苯脱蜡时间不宜长,1~3 h最佳,脱蜡过度会导致组织发硬发脆;
③浸蜡应选择低熔点的石蜡,并充分浸蜡;
④抗原修复时,高压时间过长,应适当缩短时间。
3.切片太厚,脱片,影响染色结果。
解决方法:①切片厚度视组织而定,如同淋巴结、肾等组织需要比较薄(不超过3 um),脑组织需要较厚(尤其是取新鲜标本冰冻制片时),6-8 um最佳,冰冻可切至10 um;其他一般如胃肠道、肝胆等等组织,2-4 um为宜,太厚易导致细胞重叠,影响观察;
②切片角度和刀片新旧程度对切片效果的影响较大,切片角度视切片机型号而异,新刀片更易切出完好的切片;
③捞片要求一步到位,轻夹轻放,达到无皱折、无气泡,水温控制在40℃左右;
④粘片时玻片可用多聚赖氨酸或蛋白甘油处理,或选择防脱片,以增强粘附性;
⑤烘干温度为50℃,时间为12~24 h。
4.染色不均匀。
解决方法:①切片厚度不一致,需更换刀片,调整切片机状态;
②试剂配制未混匀,导致局部浓度不一致,应将试剂充分混匀后滴加;
③在滴加试剂时让试剂完全覆盖组织;
④脱蜡不完全,可更换脱蜡剂或延长脱蜡时间。
5.切片边缘着色(边缘效应)。
解决方法:①组织边缘与玻片粘贴不牢,边缘组织松脱漂浮在液体中,每次清洗不易将组织下面试剂洗尽。玻片清洗干净后应用APES或多聚赖氨酸处理,并确保组织切片尽量薄,尽量避免选用坏死较多的组织;
②切片上滴加的试剂未覆盖均匀或未覆盖到全部组织,边缘的试剂少,容易变干,导致边缘的试剂浓度比中心区域的高,而使得染色结果偏深。滴加试剂时要均匀且充分覆盖到全部组织,为防止边缘水分减少,滴加试剂时可以适当超出组织边缘2 mm左右,保证组织部分覆盖均匀。用组化笔画圈时,距组织边缘3-4 mm为宜,避免油剂对实验结果的影响。
6.目标蛋白定位异常。
解决方法:①使用新鲜组织切片,
②固定不充分导致组织自溶,损坏,适当延长固定时间;
③根据组织大小,提高固定剂与组织的比例,切取小组织块,浸泡固定更加充分;
④固定剂使用不当,根据目标蛋白和样品组织性质选择不同固定剂;
⑤优化固定条件,包括浓度、温度、固定时间等;
⑥抗原扩散,尝试使用交联固定剂而不是有机(醇类)固定剂。
7.染色结果呈弱阳性。
解决方法:①不当的固定方式或固定时温度过高,影响待测抗原的数量和质量,应根据组织选择更适宜的固定方式及温度。
8.阳性检测率及着色强度相对减弱,甚至无染色。
解决方法:①固定液封闭了抗体识别表位,应缩短固定时间,增加抗原修复;
②靶蛋白含量低,建议增加抗体使用量或利用放大步骤来放大信号;
③靶蛋白为膜蛋白而表位可能因为渗透作用被破坏或移除,建议将缓冲液中的渗透试剂减少或移除。
④组织较厚,建议做细胞破膜,以便抗体顺利进入胞内与相应抗原结合。
抗原修复
1. 阳性检测率及着色强度相对减弱,甚至无染色。
解决方法:①抗原修复缓冲液有多种,常用的有柠檬酸盐缓冲液(pH 6.0),EDTA缓冲液(pH 8.0-9.0),Tris / Tris-EDTA缓冲液(pH 9.0-10.0),和胰酶(pH 3.5±0.2),修复液的PH值对染色结果的影响比较大,具体选择应视情况而定;
②抗原修复不足,由于固定步骤引起的蛋白交联导致抗原仍未被修复会导致染色减弱,需使用正确的抗原修复方法,如微波热修复及高压热修复等;
③迅速冷却,加热结束后迅速用冷水浇淋使修复液急速降温,可能造成抗原暴露不充分,且降温太快,组织和载玻片的收缩系数不同易使组织脱片,应采用平缓冷却,即让修复液温度平缓下降的方式。
2.背景染色较深。
解决方法:①固定过度,需摸索修复条件,改变抗原修复方法或减小抗原修复强度;
②抗原修复过程中,切片干涸。修复液溢出后未及时补充液体、染色切片太多、动作太慢、忘记滴液、滴液流失等都是造成组织变干的原因。解决的办法是操作要认真仔细,采用DAKO笔或PAP Pen在组织周围画圈,可以有效的避免液体流失,提高操作速度;
③避免切片在缓冲液或修复液中浸泡时间过长(大于 24 h)。
3.结果出现弱阳。
解决方法:①不适当的抗原修复方式,导致抗原决定簇暴露不足,需摸索修复条件,改变抗原修复方法。
4.目标蛋白定位异常。
解决方法:①抗原修复过强,导致组织结构被破坏,蛋白转移。应优化抗原修复程序或尝试不同的抗原修复方法,注意保留组织完整形态。
新品上市
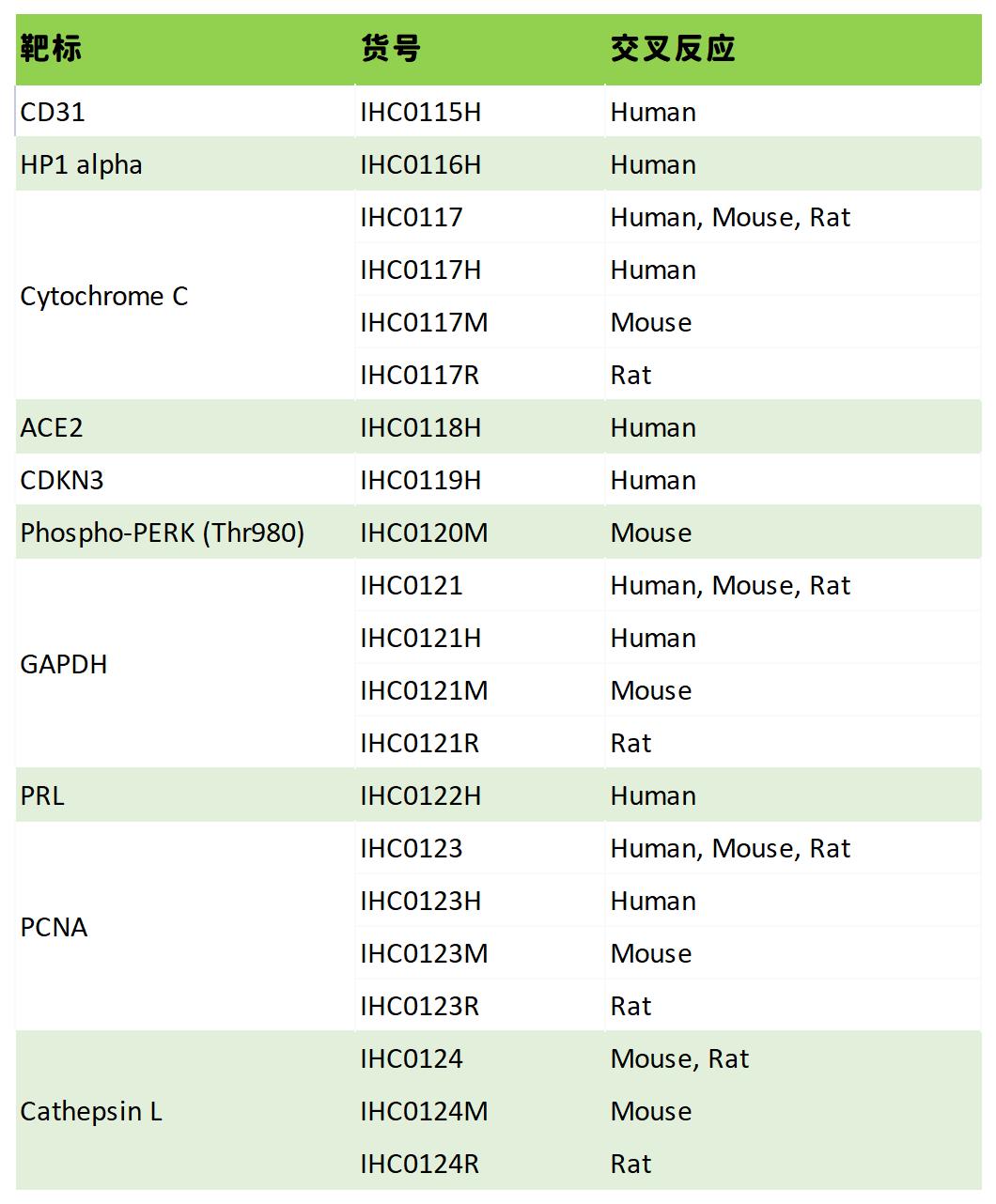
热销产品
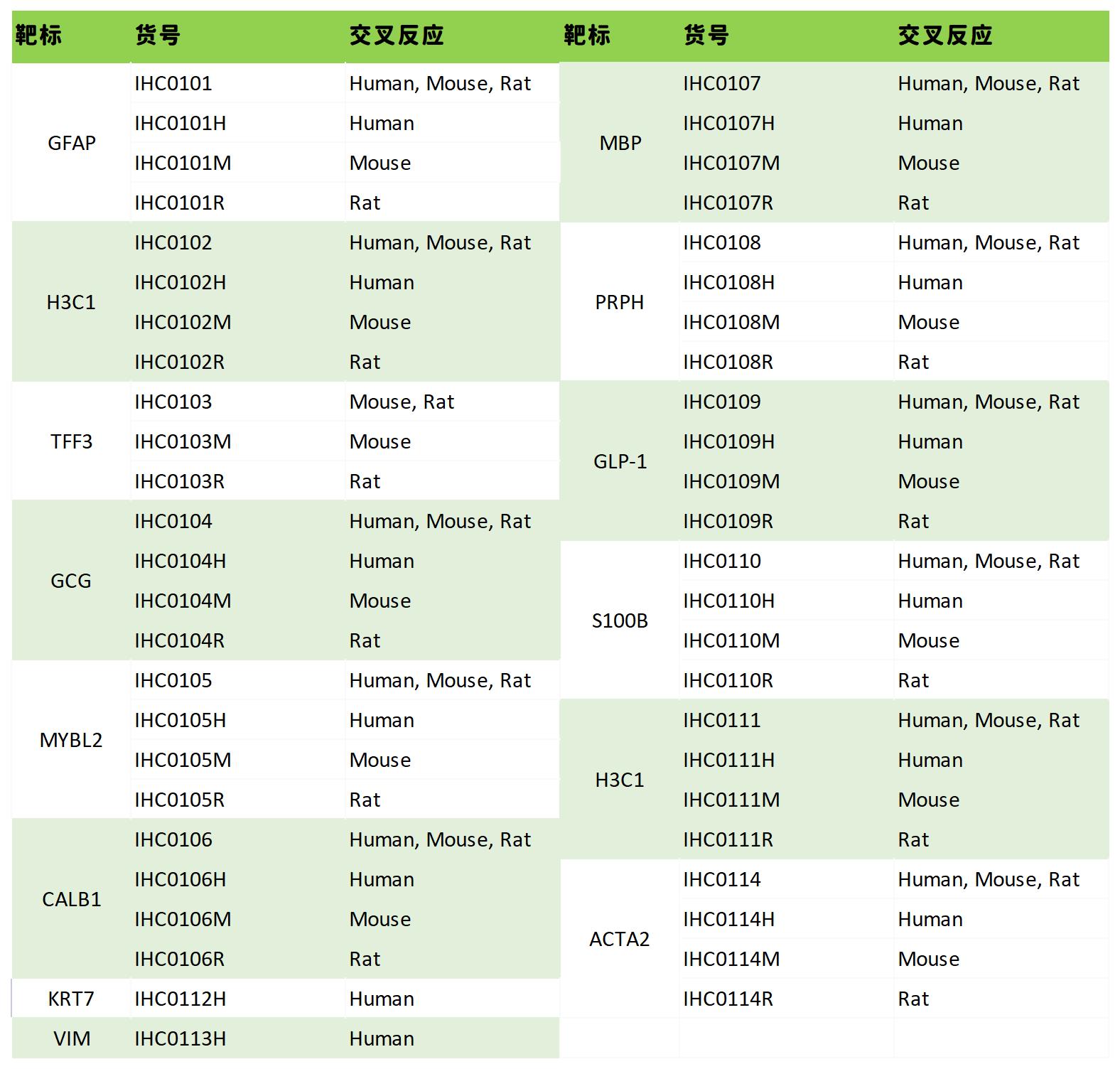
受篇幅限制,本次IHC实验过程中的常见问题解析就先分享到这里。如果您还想更深入的学习IHC相关问题,可以继续关注本系列后续文章。如果您在使用我们的产品时出现任何问题,请随时联系我们,Bioss资深IHC实验专家将为您全面讲解,深度分析,帮助您轻松解决IHC的“疑难杂症”!
